昆明动物所揭示阿尔茨海默病发病早期脉络丛的细胞与分子病理变化特征
脉络丛作为脑脊液的分泌组织和血液-脑脊液屏障,其分泌的脑脊液包裹着整个神经系统,不仅发挥机械缓冲与支持作用,还参与神经系统的功能调控以及代谢废物清除过程。同时,作为血液和脑脊液之间的屏障,脉络丛选择性调控物质交换,对维持脑脊液成分稳定、保障神经系统营养供给和内环境稳态至关重要。近年来,多项研究报道显示,在AD、帕金森病、肌萎缩侧索硬化和多发性硬化症等神经退行性疾病患者中,脉络丛体积显著增大;年轻健康小鼠脑脊液移植,可改善老年或AD模型小鼠认知功能。这些结果说明,脉络丛在神经退行性疾病发生发展过程中发挥着重要的作用。然而,由于脉络丛组织体积小、取样困难,目前关于AD模型中脉络丛病理变化与功能分析的研究仍然不多,特别是AD发病早期脉络丛的病理功能变化,了解有限,或多或少地阻碍了基于脉络丛的AD早期干预策略的研发。
中国科学院昆明动物研究所研究员姚永刚和张登峰团队首次构建了AD相关的脉络丛单细胞转录图谱,这是迄今为止细胞捕获数最多的脉络丛单细胞数据。基于转录组分析、原位验证和体外靶点干预实验,全面地阐释了AD小鼠病理早期的脉络丛的细胞和分子病理变化特征。该研究发现,脉络丛由上皮细胞、免疫细胞、内皮细胞、平滑肌细胞和周细胞等6大类细胞组成,其中上皮细胞约占细胞总数的3/4。这些上皮细胞通过紧密连接形成屏障结构,并高表达线粒体基因、纤毛基因、多种受体基因、激素与离子转运体基因等。相对于同性别的正常对照小鼠,雄性AD小鼠中的上皮细胞比例显著降低,线粒体能量代谢下降,纤毛组分明显减少且极性改变。原位和体外实验显示,AD早期脉络丛上皮细胞通透性增加,提示其屏障功能受损。该研究还发现,脉络丛中包含多种髓系(M1/M2型巨噬细胞、树突状细胞、中性粒细胞)和淋巴系(T细胞、自然杀伤细胞、B细胞)免疫细胞亚群,且部分淋巴细胞、巨噬细胞和树突状细胞亚群同时表达增殖信号(如Mki67、Stmn1和Top2a等),表明脉络丛具有“淋巴结样”免疫细胞原位增殖的特性。AD病理早期的小鼠中,脉络丛上皮细胞的巨噬细胞迁移抑制因子(MIF)表达下调,导致免疫细胞通讯紊乱,引起巨噬细胞激活。体外实验发现,抑制MIF可显著增强Aβ或脂多糖(LPS)诱导的炎症反应,促进了巨噬细胞对Aβ的吞噬,展现出MIF介导的巨噬细胞炎症反应和Aβ清除能力的"双刃剑"效应。此外,脉络丛中的巨噬细胞可穿越脉络丛进入脑脊液,并与室管膜细胞直接作用。同时,巨噬细胞还可通过增加APOE和APOJ等配体分泌,增强其与室管膜受体(如LRP1、LRP8和SDC4等)的互作,从而促进皮层组织脂质积累和小胶质细胞激活等AD下游病理效应(如图1所示)。
该研究工作绘制了AD发病早期脉络丛在单细胞分辨率下的转录组及病理变化特征图谱,为脉络丛作为屏障系统和免疫单元参与AD病理的作用机制,提供了新的视角,为研发靶向脉络丛的潜在AD干预策略提供了科学依据,此外,该研究发现脉络丛的基因表达谱存在明显的性别差异,这为后续基于AD性别差异的病理机制研究和疾病干预,提供了数据支持。
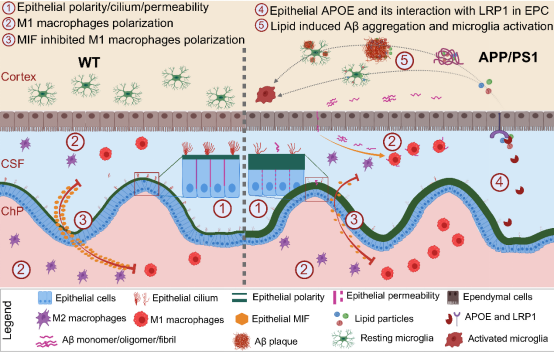
图1. 脉络丛病理异常促进阿尔茨海默病(AD)的发生与发展。AD模型小鼠的脉络丛在受到来自脑实质的Aβ刺激后,其纤毛结构、上皮细胞极性及屏障通透性均发生病理性改变。同时,AD小鼠脉络丛上皮细胞分泌的巨噬细胞迁移抑制因子(MIF)减少,导致脉络丛巨噬细胞活化。这些活化的巨噬细胞及其他脉络丛细胞通过分泌APOE等配体,调控室管膜细胞的脂质转运功能,最终引发脑实质脂质积累与小胶质细胞活化。
近日,以上研究以Early transcriptional and cellular abnormalities in choroid plexus of a mouse model of Alzheimer’s disease为题,发表于Molecular Neurodegeneration。
文章链接:https://doi.org/10.1186/s13024-025-00853-w
作者:闫忠江
