昆明动物所成功建立首个模拟人类神经退行性疾病A-T的非人灵长类模型
在众多罕见病中,小儿共济失调-毛细血管扩张症(Ataxia-Telangiectasia,简称A-T)被称为“最令人心碎的儿童疾病之一”。这是一种由ATM基因突变引起的严重遗传性神经退行性疾病,虽然发病率极低(大约每十万名新生儿中仅有一至两名患儿),但其残酷的病程和无法治愈的现实,却让无数家庭陷入绝望。A-T患儿通常在婴儿期就会出现运动协调异常,最早在6个月大时,家长就会发现孩子不会像其他婴儿一样稳稳坐下或伸手拿东西。到1岁左右,典型的小脑性共济失调症状就会出现:孩子无法保持平衡、走路摇晃、频繁跌倒。随着年龄增长,症状逐渐加重,许多患儿在青春期前后就彻底失去行走能力,被迫依赖轮椅。除了严重的运动障碍,A-T患儿还常常伴随免疫功能缺陷,容易反复感染;眼结膜等部位会出现明显的毛细血管扩张;体内的甲胎蛋白(AFP)水平升高;他们对放射线和DNA损伤格外敏感;同时,患肿瘤的风险大大增加。可以说,这是一种多系统受累的复杂疾病。然而,截至目前,A-T没有有效的治疗方法。医生只能通过对症治疗来延缓病情,比如免疫支持治疗、物理康复训练、减少感染风险等,但这些手段无法阻止疾病的进展。很多父母只能眼睁睁看着孩子从跌跌撞撞到完全无法行走,再到被各种并发症折磨。长期的心理压力和护理负担,也让家庭身心俱疲。
然而,目前常用的小鼠模型仅能模拟ATM基因缺失导致的部分系统表型,无法重现患者核心的小脑特异性萎缩、进行性共济失调等中枢神经系统病变,导致科学家长期缺乏能忠实反映人类疾病特征的实验体系,既严重制约A-T发病机理的系统性解析,也成为相关药物研发走向临床的关键瓶颈;而非人灵长类(如猕猴)的大脑结构、神经发育模式与人类高度相似,其小脑功能和病变特点更贴近人类患者,因此构建能全面模拟人类A-T所有核心症状的非人灵长类模型,已成为推进A-T研究、助力药物研发的必然选择与迫切需求,更是无数患者和家庭的期待。
近日,中国科学院昆明动物研究所李家立研究员团队,联合吴东东研究员、姚永刚研究员和郑萍研究员团队,首次利用CRISPR-Cas9基因编辑技术,在猕猴胚胎中对ATM基因进行精准敲除,成功创建了ATM功能缺失的猕猴模型。这些基因修饰猕猴在出生后,逐渐表现出与A-T患儿高度一致的临床特征:生长迟缓——体重、身长的增长明显落后于同龄猕猴;免疫功能缺陷——更容易感染;眼结膜毛细血管扩张——与人类患者外观表现相似;血清AFP水平升高——与人类A-T患儿血液指标一致;对辐射和DNA损伤敏感——再次证明ATM缺失的核心影响;最令人瞩目的发现是这些猕猴首次完整再现了A-T小脑逐渐萎缩和严重运动失调的过程。研究人员通过行为学、影像学和病理学的多重验证发现:ATM缺陷型猕猴在MRI等脑影像学检查中表现出进行性的小脑体积萎缩,并伴随有下肢运动功能障碍;组织病理学分析发现,小脑浦肯野细胞数量显著减少,这是小脑运动控制功能受损的核心原因之一;在超微结构层面,浦肯野细胞呈现线粒体肿胀、髓鞘结构变薄等典型退行性特征;更为重要的是,研究人员首次发现小脑分子层中间神经元的基因表达发生紊乱,提示这些神经元的异常可能是导致浦肯野细胞退化的重要机制。这一发现为揭示A-T的神经退行性病程提供了全新线索,也提出了一个新的科学假设:或许在治疗A-T的过程中,除了关注浦肯野细胞本身,还应该关注调控它们功能的分子层中间神经元。
这一研究的意义不仅仅在于创建了全球首个能真实模拟A-T神经系统损伤的非人灵长类动物模型,同时也是目前唯一能系统研究这一罕见病神经退行性机制的模型。该研究弥补了长期以来小鼠模型的不足,证明ATM基因缺失与A-T病程的直接因果关系,并为进一步探索发病机制、寻找新的分子靶点提供了关键依据。同时,该模型创建也为新药研发和疗效评估提供了一个高度可靠的实验平台,让研究人员在猕猴这样更接近人类的动物身上测试药物安全性和有效性成为可能。
该研究结果以“ATM deficiency drives phenotypic diversity and Purkinje cell degeneration in a macaque model of Ataxia-Telangiectasia”(ATM缺陷猕猴模型出现多种A-T症状并引发小脑神经细胞退化)为题,于2025年9月16日在线发表在国际知名学术期刊Cell Reports Medicine上。
中国科学院昆明动物研究所副研究员徐开宇、高级工程师张莹、博士研究生陈勇璇、朱晓嘉、助理研究员李余和正高级工程师吕龙宝为该论文的共同第一作者。昆明动物研究所李家立研究员、吴东东研究员和姚永刚研究员为该论文通讯作者,该工作同时得到昆明动物研究所郑萍研究员和张登峰研究员、匹兹堡大学Karl Herrup教授、汕头大学李凡教授的大力帮助。该项研究工作依托“模式动物表型与遗传研究国家重大科技基础设施(灵长类)”开展,获得国家科技部、国家自然科学基金委、云南省科技厅和中国科学院等项目资助。
原文链接:https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(25)00428-8
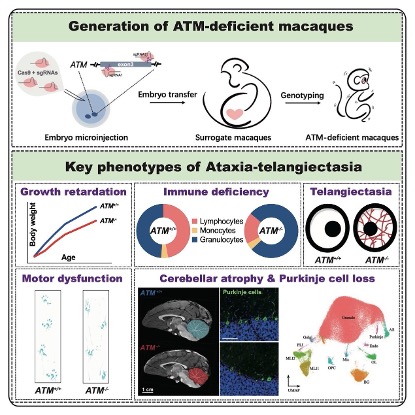
A-T猕猴模型模式图
作者:徐开宇
